 | Образцы готовых курсовых, контрольных, дипломных работ, рефератов и задач | |
Главная → Физколлоидная химия→Вариант 7
Работы с данного сайта предназначены исключительно для ознакомления. Все права в отношении работы принадлежат ее законному правообладателю. Оплата доступа не предполагает продажу работы или прав на неё. Мы оказываем услуги подбора и систематизации информации. Сайт не несет ответственности за правильность теоретической и (или) практической частей в работе. Ответственность за неправомерное и незаконное использование работы лежит на пользователе. Полное или частичное воспроизведение и распространение учебных материалов сайта запрещено. Услуга предоставляется «как есть» ("as is") и в том виде, в котором она доступна на момент предоставления, при этом никаких гарантий прямых или косвенных, не предоставляется (включая, но не ограничиваясь, гарантии по использованию Услуги в конкретных целях). Копирование материалов с сайта запрещено.
Политика конфиденциальности: Мы высоко ценим Ваш интерес к нашему проекту. Защита персональных данных для нас очень важна. Мы соблюдаем правила защиты персональных данных и защиты ваших данных от несанкционированного доступа третьих лиц (защита персональных данных).
Заполнение формы с контактными данными означает безоговорочное согласие с настоящей Политикой конфиденциальности и указанными в ней условиями обработки персональной информации.
Ниже приводится информация об обработке персональных данных.
1. Персональные данные. Цель сбора и обработки персональных данных.
1.1. Вы всегда можете посетить данную страницу, не раскрывая никакой персональной информации.
1.2. Под персональными данными понимается любая информация, относящаяся к определенному или определяемому на основании такой информации физическому лицу.
1.3. Мы собираем и используем персональные данные, необходимые для выполнения Вашего запроса, это – фамилия, имя, телефон и электронный адрес.
1.4. Мы не проверяем достоверность персональных данных, предоставляемых физическими лицами, и не проверяет их дееспособность.
2. Условия обработки персональной информации покупателя и её передачи третьим лицам.
2.1. При обработке персональных данных посетителей сайта мы руководствуется Федеральным законом РФ «О персональных данных».
2.2. В отношении персональной информации покупателя сохраняется ее конфиденциальность.
2.3. Мы не передаем персональные данные третьим лицам.
3. Меры, применяемые для защиты персональной информации пользователей.
Мы принимаем необходимые и достаточные организационные и технические меры для защиты персональной информации пользователя от неправомерного или случайного доступа, уничтожения, изменения, блокирования, копирования, распространения, а также от иных неправомерных действий с ней третьих лиц.
ИП Сатаев Тимур Сагитович ОГРН 311028003900327
Поиск: введите тему контрольной или курсовой работы, условие задачи или тип работы.
Вступайте в нашу группу ВКонтакте!
Выполняем нормоконтроль
От вас нужна методичка с требованиями по оформлению работы и сам документ в электронном виде.
Стоимость 10-30 р./страница.
Возможен срочный заказ.
Обращайтесь на нашу страницу ВКонтакте.
Скажи плагиату "НЕТ"!
Повысим оригинальность вашего текста, переписав его своими словами (Рерайт)
Без трюков
Без скрытых символов
Без перекодировок
Пишите на нашу страницу ВКонтакте.
Предоставим отчет об оригинальности
Обращайтесь сейчас!
Задание 1.1.1 Применение законов термодинамики к изопроцессам
расширяется обратимо и адиабатически вдвое по объему. Начальная температура 298,15 К, давление 15 атм. Конечная температура 248,44 К. Определить V1, V2, р2, сv и сp.
Задание 1.1.2 Термодинамические расчеты
Для реакции, приведенной в таблице 1.3, соответствующей вашему варианту:
1) рассчитайте стандартный тепловой эффект реакции по известным величинам стандартных теплот образования исходных веществ и продуктов реакции;
2) определите DНт из предположения:
а) Dс = 0;
б) Dс = const;
в) Dс = f (Т).
3) постройте на одном графике зависимости Sспрод = f (Т) для продуктов и
Sсисх = f (Т) для исходных реагентов;
4) постройте график зависимости DНТ = f (Т) в интервале (298К Т);
5) определите и DSТ для реакции;
6) вычислите значение и DGТ и сделайте вывод о направлении реакции в стандартных условиях и при температуре Т.
Задание 1.2.1.Анализ фазовой диаграммы
По зависимости давления насыщенного пара от температуры и плотности данного вещества А в твердом и жидком состояниях (dтв и dж в кг/м3, М в г/моль ) в тройной точке (тр. т.):
1) постройте график зависимости ln р =f( 1/Т);
2) определите по графику координаты тройной точки;
3) рассчитайте среднюю теплоту испарения и возгонки;
4) определите приближенно температуру кипения вещества при нормальном давлении и проверьте применимость правила Трутона;
5) определите теплоту плавления вещества при температуре тройной точки Ттр.т;
6) вычислите dT/dP для процесса плавления при температуре тройной точки;
7) вычислите температуру плавления вещества при давлении р, Па;
8) вычислите изменение энтропии, изобарно-изотермического потенциала, внутренней энергии и работы для процесса возгонки 1 моль вещества в тройной точке;
9) определите число термодинамических степеней свободы при следующих значениях температуры и давления: а) Ттр.т, ртр.т; б) Тн.т.к., р=1 атм; в) Тн.т.к., ртр.т..
Необходимые для расчета данные приведены в таблице 1.2, согласно вашему варианту.
Задание 1.3.2 Кинетика реакций целого порядка, влияние температуры на скорость реакции.
Для реакции, приведенной в таблице 1.3.2, соответствующей вашему варианту:
1) определите энергию активации и предэкспоненциальный множитель по значениям констант скоростей реакции k1 и k2 при двух температурах;
2) рассчитайте константу скорости при температуре Т3. Сделайте вывод о влиянии температуры на скорость вашей реакции;
3) определите количество вещества, израсходованное за время t при Т3, если начальные концентрации равны C0;
4) рассчитайте период полупревращения при T3.
Таблица 1.3.2 Варианты к заданию 1.3.2
№ реакция Т1, К k1 T2, К k2 Т3, К t, мин c0, моль/л
7 (C2H5)3N CH3I ® [(C2H5)3CH3N]I 298 3,29Ч10-2 л/моль Ч с 303 8,1 Ч 10-2 л/моль Ч с 343 20 0,02
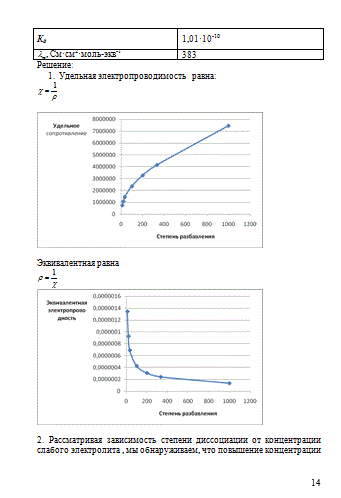
Задание 1.4.1. Электропроводность растворов
Используя данные таблицы 4.2 о свойствах раствора вещества в воде, решите следующие задачи:
1) постройте графики зависимости удельной и эквивалентной электропроводности раствора вещества от разбавления V;
2) проверьте, подчиняется ли раствор вещества А в воде закону разбавления Оствальда.
3) вычислите абсолютные скорости и числа переноса аниона и катиона при бесконечном разбавлении.
Таблица 1.4.2 Зависимость удельного сопротивления раствора вещества (Ом?см) от концентрации при Т=298 К
Данный сайт использует файлы cookie. Продолжая пользоваться сайтом вы соглашаетесь с этим.
Политика конфиденциальности
Условия скачивания работ (лицензионное соглашение).Работы с данного сайта предназначены исключительно для ознакомления. Все права в отношении работы принадлежат ее законному правообладателю. Оплата доступа не предполагает продажу работы или прав на неё. Мы оказываем услуги подбора и систематизации информации. Сайт не несет ответственности за правильность теоретической и (или) практической частей в работе. Ответственность за неправомерное и незаконное использование работы лежит на пользователе. Полное или частичное воспроизведение и распространение учебных материалов сайта запрещено. Услуга предоставляется «как есть» ("as is") и в том виде, в котором она доступна на момент предоставления, при этом никаких гарантий прямых или косвенных, не предоставляется (включая, но не ограничиваясь, гарантии по использованию Услуги в конкретных целях). Копирование материалов с сайта запрещено.
Политика конфиденциальности: Мы высоко ценим Ваш интерес к нашему проекту. Защита персональных данных для нас очень важна. Мы соблюдаем правила защиты персональных данных и защиты ваших данных от несанкционированного доступа третьих лиц (защита персональных данных).
Заполнение формы с контактными данными означает безоговорочное согласие с настоящей Политикой конфиденциальности и указанными в ней условиями обработки персональной информации.
Ниже приводится информация об обработке персональных данных.
1. Персональные данные. Цель сбора и обработки персональных данных.
1.1. Вы всегда можете посетить данную страницу, не раскрывая никакой персональной информации.
1.2. Под персональными данными понимается любая информация, относящаяся к определенному или определяемому на основании такой информации физическому лицу.
1.3. Мы собираем и используем персональные данные, необходимые для выполнения Вашего запроса, это – фамилия, имя, телефон и электронный адрес.
1.4. Мы не проверяем достоверность персональных данных, предоставляемых физическими лицами, и не проверяет их дееспособность.
2. Условия обработки персональной информации покупателя и её передачи третьим лицам.
2.1. При обработке персональных данных посетителей сайта мы руководствуется Федеральным законом РФ «О персональных данных».
2.2. В отношении персональной информации покупателя сохраняется ее конфиденциальность.
2.3. Мы не передаем персональные данные третьим лицам.
3. Меры, применяемые для защиты персональной информации пользователей.
Мы принимаем необходимые и достаточные организационные и технические меры для защиты персональной информации пользователя от неправомерного или случайного доступа, уничтожения, изменения, блокирования, копирования, распространения, а также от иных неправомерных действий с ней третьих лиц.
ИП Сатаев Тимур Сагитович ОГРН 311028003900327
Ознакомиться с политикой конфиденциальности
Алфавитный указатель по дисциплинам:
Поиск: введите тему контрольной или курсовой работы, условие задачи или тип работы.
На сайте имеется 23986 работ. Воспользуйтесь поиском, чтобы найти нужную вам работу
Вступайте в нашу группу ВКонтакте!
Выполняем нормоконтроль
От вас нужна методичка с требованиями по оформлению работы и сам документ в электронном виде.
Стоимость 10-30 р./страница.
Возможен срочный заказ.
Обращайтесь на нашу страницу ВКонтакте.
Скажи плагиату "НЕТ"!
Повысим оригинальность вашего текста, переписав его своими словами (Рерайт)
Без трюков
Без скрытых символов
Без перекодировок
Пишите на нашу страницу ВКонтакте.
Предоставим отчет об оригинальности
Обращайтесь сейчас!
Вариант 7
Описание работы:
Задание 1.1.1 Применение законов термодинамики к изопроцессам
7. Один моль фторуглерода
расширяется обратимо и адиабатически вдвое по объему. Начальная температура 298,15 К, давление 15 атм. Конечная температура 248,44 К. Определить V1, V2, р2, сv и сp.Задание 1.1.2 Термодинамические расчеты
Для реакции, приведенной в таблице 1.3, соответствующей вашему варианту:
1) рассчитайте стандартный тепловой эффект реакции по известным величинам стандартных теплот образования исходных веществ и продуктов реакции;
2) определите DНт из предположения:
а) Dс = 0;
б) Dс = const;
в) Dс = f (Т).
3) постройте на одном графике зависимости Sспрод = f (Т) для продуктов и
Sсисх = f (Т) для исходных реагентов;
4) постройте график зависимости DНТ = f (Т) в интервале (298К Т);
5) определите и DSТ для реакции;
6) вычислите значение и DGТ и сделайте вывод о направлении реакции в стандартных условиях и при температуре Т.
Задание 1.2.1.Анализ фазовой диаграммы
По зависимости давления насыщенного пара от температуры и плотности данного вещества А в твердом и жидком состояниях (dтв и dж в кг/м3, М в г/моль ) в тройной точке (тр. т.):
1) постройте график зависимости ln р =f( 1/Т);
2) определите по графику координаты тройной точки;
3) рассчитайте среднюю теплоту испарения и возгонки;
4) определите приближенно температуру кипения вещества при нормальном давлении и проверьте применимость правила Трутона;
5) определите теплоту плавления вещества при температуре тройной точки Ттр.т;
6) вычислите dT/dP для процесса плавления при температуре тройной точки;
7) вычислите температуру плавления вещества при давлении р, Па;
8) вычислите изменение энтропии, изобарно-изотермического потенциала, внутренней энергии и работы для процесса возгонки 1 моль вещества в тройной точке;
9) определите число термодинамических степеней свободы при следующих значениях температуры и давления: а) Ттр.т, ртр.т; б) Тн.т.к., р=1 атм; в) Тн.т.к., ртр.т..
Необходимые для расчета данные приведены в таблице 1.2, согласно вашему варианту.
Задание 1.3.2 Кинетика реакций целого порядка, влияние температуры на скорость реакции.
Для реакции, приведенной в таблице 1.3.2, соответствующей вашему варианту:
1) определите энергию активации и предэкспоненциальный множитель по значениям констант скоростей реакции k1 и k2 при двух температурах;
2) рассчитайте константу скорости при температуре Т3. Сделайте вывод о влиянии температуры на скорость вашей реакции;
3) определите количество вещества, израсходованное за время t при Т3, если начальные концентрации равны C0;
4) рассчитайте период полупревращения при T3.
Таблица 1.3.2 Варианты к заданию 1.3.2
№ реакция Т1, К k1 T2, К k2 Т3, К t, мин c0, моль/л
7 (C2H5)3N CH3I ® [(C2H5)3CH3N]I 298 3,29Ч10-2 л/моль Ч с 303 8,1 Ч 10-2 л/моль Ч с 343 20 0,02
Задание 1.4.1. Электропроводность растворов
Используя данные таблицы 4.2 о свойствах раствора вещества в воде, решите следующие задачи:
1) постройте графики зависимости удельной и эквивалентной электропроводности раствора вещества от разбавления V;
2) проверьте, подчиняется ли раствор вещества А в воде закону разбавления Оствальда.
3) вычислите абсолютные скорости и числа переноса аниона и катиона при бесконечном разбавлении.
Таблица 1.4.2 Зависимость удельного сопротивления раствора вещества (Ом?см) от концентрации при Т=298 К
Примерный внешний вид работы:

Тип работы: Контрольная работа
Похожие работы:
Дисциплина | Название работы | Тип работы | Примечание |
| Физколлоидная химия | Вариант 17 Задание 1.1.1 Применение законов термодинамики к изопроцессам 17. 30 г ... | Контрольная работа | |
| Физколлоидная химия | Задание 1.1 Применение законов термодинамики к изопроцессам 17. 30 г хлора, взятого ... | Задание |